

Vol. 38 (Nº 47) Ano 2017. Pág. 24
Eduarda Demari AVRELLA 1; Bruna BARATTO 2; Júlio Rieger LUCCHESE 3; Márcio Carlos NAVROSKI 4; Claudimar Sidnei FIOR 5
Recebido: 01/06/2017 • Aprovado: 25/06/2017
RESUMO: O objetivo foi avaliar os efeitos do estresse hídrico e da salinidade na germinação de sementes e desenvolvimento de plântulas M. scabrella. Realizaram-se dois experimentos com diferentes potenciais osmóticos das soluções de PEG 6000 e NaCl. Os resultados demonstraram que a bracatinga é uma espécie promissora para cultivo em solos com estresse hídrico, seja por baixa precipitação, seja por solo salino, pois a germinação e a formação de plântulas ocorreram de forma satisfatória em potenciais osmóticos que estes solos apresentam. |
ABSTRACT: |
A utilização de espécies nativas de uso múltiplo constitui-se em uma importante alternativa para o aproveitamento de áreas ociosas, já que nestas condições a exploração de muitas espécies é inviável economicamente (Silva et al., 2009). Assim, a demanda por conhecimento sobre o comportamento de espécies nativas é cada vez maior, em função das suas potencialidades ambientais e econômicas. De acordo com NAVROSKI & PEREIRA (2014), a bracatinga (Mimosa scabrella Benth.) é uma espécie com potencial para se tornar comercialmente viável devido ao seu rápido crescimento, capacidade de desenvolvimento em sítios desfavoráveis, qualidade da madeira para energia e outros fins, potencialidade de uso melífero e em sistemas agroflorestais.
A bracatinga é uma leguminosa pioneira de rápido crescimento, apresenta média geral de 10 a 18 metros de altura e 20 a 30 centímetros de DAP (diâmetro a altura do peito – 1,30 m acima do solo), podendo atingir de 20 a 25 m de altura e 40 a 50 cm de DAP após oito anos de idade (Fabrowski et al., 2005). Suas sementes apresentam dormência causada pela impermeabilidade do tegumento, que resulta em dificuldade de germinação, mesmo em condições ideais de temperatura e umidade (Rosa et al., 2012). O principal e mais importante uso da sua madeira é para energia, como lenha e, secundariamente como carvão. É utilizada ainda na construção civil em obras internas, como vigamentos, escoras e assoalhos, na fabricação de aglomerados, compensados, caixotaria e laminação para usos diversos. Possui potencial ornamental na arborização urbana, além de ser indicada na recuperação de áreas degradadas e adubação verde (Machado et al., 2006).
Em condições naturais, há condições que podem limitar o desenvolvimento e a sobrevivência das plantas, como por exemplo, o estresse hídrico e a salinidade do solo (Moura et al., 2011). Algumas espécies apresentam resistência em relação às variações no potencial hídrico, onde as mais tolerantes possuem vantagem sobre as mais sensíveis. Esta característica torna-se importante para fins de recomendações para o plantio de espécies capazes de suportar diferentes condições de potenciais osmóticos em diversas situações ecológicas, principalmente ao considerar os solos salinos e áreas com baixa disponibilidade hídrica (Rego et al., 2011).
Sob o ponto de vista evolutivo, o estresse hídrico imposto por condições ambientais naturais nem sempre age de forma negativa, pois pode atuar na seleção e estabelecimento de espécies ao longo do tempo, permitindo que elas sobrevivam em condições adversas (Larcher, 2000). Estas adaptações vêm sendo estudadas por vários métodos, um deles é a capacidade germinativa das sementes, bem como o crescimento e desenvolvimento das plântulas (Rego et al., 2011; Gordin et al., 2012; Pereira et al., 2012; Pelegrini et al., 2013).
Diante do exposto, o objetivo deste trabalho foi avaliar os efeitos do estresse hídrico e da salinidade, simulados por soluções de polietilenoglicol (PEG 6000) e cloreto de sódio (NaCl) na germinação de sementes e desenvolvimento de plântulas de Mimosa scabrella Benth.
O presente estudo foi conduzido no Laboratório de Biotecnologia da Universidade Federal do Rio Grande do Sul, em Porto Alegre, RS, entre os meses de abril e outubro de 2014. As sementes foram coletadas de oito matrizes no município de Santo Antônio do Palma (RS), em dezembro de 2012 (exsicata registrada no herbário da UFRGS, ICN 184890), e armazenadas em refrigerador a 5°C até a realização do experimento.
As sementes de bracatinga foram submetidas à quebra de dormência pelo método de imersão em água quente (90°C) até atingir temperatura ambiente, o qual foi determinado em estudo piloto como sendo o mais prático e rápido para a quebra de dormência das sementes de bracatinga. Posteriormente, foram dispostas em caixas plásticas transparentes (tipo gerbox) contendo uma folha de papel germiteste autoclavado como substrato. Estes papéis foram umedecidos na proporção de 2,5 vezes a sua massa seca, com as soluções de NaCl e PEG 6000 correspondente a cada tratamento, as quais consistiram em simular a salinidade e o déficit hídrico, respectivamente.
O primeiro experimento correspondeu aos seguintes potenciais osmóticos: 0,0; -0,3; -0,6; -0,9 e -1,2 MPa. Com base nos resultados obtidos neste experimento, um segundo estudo foi conduzido com as mesmas soluções em níveis mais baixos de potencial osmótico (0,0; -0,15; -0,3 e -0,45 MPa). Para alcançar tais potenciais, foram utilizadas as seguintes fórmulas: para o NaCl a equação de Van’tHoff, utilizada por BETONI et al. (2011), e para o PEG 6000 a equação de MICHEL & KAUFMANN (1973).
Após a semeadura, as caixas gerbox foram mantidas em sala de germinação com fotoperíodo de 16 horas (30 µmol.m-2.s-1) e temperatura constante de 25°C. O número de sementes germinadas e o número de plântulas normais formadas foram avaliados a cada dois dias, e os experimentos foram encerrados quando em três avaliações consecutivas não houve germinação e formação de plântulas. Foram consideradas germinadas as sementes que apresentaram protrusão radicular maior ou igual a 2 mm, e plântulas normais as que apresentaram parte aérea e sistema radicular visíveis a olho nu. Em cada avaliação, os papéis foram umedecidos com 1 mL das respectivas soluções de cada tratamento, e água deionizada autoclavada no tratamento controle.
As variáveis avaliadas consistiram na porcentagem de germinação, tempo médio de germinação (TMG), tempo médio para formação de plântulas (TMP) e índice de velocidade de germinação (IVG), o qual foi calculado pela equação de MAGUIRE (1962), modificada conforme SANTANA & RANAL (2004), com base na soma do número de sementes germinadas, plântulas emergidas ou plântulas formadas em cada avaliação, dividido pelo respectivo tempo, dividindo-se o resultado final pelo número total de sementes germinadas, plântulas emergidas ou plântulas formadas em cada repetição.
Os tratamentos foram dispostos em delineamento experimental inteiramente casualizado, distribuídos em arranjo fatorial 2 x 5 com quatro repetições de 50 sementes para o primeiro experimento, e arranjo fatorial 2 x 4 com quatro repetições de 25 sementes para o segundo experimento. O primeiro fator correspondeu aos agentes osmóticos (NaCl e PEG 6000) e o segundo fator aos potenciais osmóticos (0,0; -0,3; -0,6; -0,9; -1,2 MPa e 0,0; -0,15; -0,3; -0,45 MPa). Os dados foram submetidos à análise de variância (ANOVA) e comparação de médias (DMS) a 5% de probabilidade de erro pelo software Costat 6.4, e regressão pelo SigmaPlot 11.0.
A análise estatística dos dados mostrou que para os dois experimentos houve interação entre os agentes e os potencias osmóticos para a germinação das sementes (Tabela 1). Devido aos baixos valores de porcentagem de germinação obtidos nos tratamentos com PEG 6000 no experimento A, não foi possível estimar o índice de velocidade de germinação e o tempo médio de germinação.
Tabela 1
Análise de variância de dois experimentos com germinação de sementes
e formação de plântulas de bracatinga (Mimosa scabrella Benth.) em substrato
hidratado com dois agentes osmóticos (NaCl e PEG 6000) em gradientes de concentrações.
Valor P |
Experimento A |
Experimento B |
||||
Germinação (%) |
TMP (dias) |
Germinação (%) |
IVGm |
TMG (dias) |
TMP (dias) |
|
Agente osmótico |
<0,001 |
0,002 |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
Potencial osmótico |
<0,001 |
0,1169ns |
<0,001 |
<0,001 |
0,1218ns |
0,6582ns |
Interação |
<0,001 |
0,2707ns |
<0,001 |
0,1835ns |
0,0574ns |
0,0655ns |
Média geral |
36,47 |
8,79 |
53,12 |
0,14 |
7,58 |
13,4 |
CV (%) |
34,72 |
76,46 |
26,02 |
32,31 |
66,33 |
51,26 |
GL erro |
26 |
26 |
24 |
24 |
24 |
24 |
Experimento A consistiu nos potenciais osmóticos de 0,0; -0,3; -0,6; -0,9 e -1,2 MPa dos agentes osmóticos NaCl e PEG 6000, e o experimento B consistiu nos potenciais de 0,0; -0,15; -0,3 e -0,45 MPa dos mesmos agentes osmóticos; ns não significativo a 5% de probabilidade de erro; TMP = tempo médio de formação de plântulas; TMG = tempo médio de germinação; IVGm = índice de velocidade de germinação médio; CV = coeficiente de variação; GL erro = grau de liberdade do erro.
Os resultados dos dois experimentos mostraram que, independente do agente osmótico, houve redução drástica na porcentagem de germinação à medida que o potencial osmótico do meio tornou-se mais negativo (Figura 1A e 1B). Entretanto, quando comparados os efeitos dos dois agentes osmóticos, pode-se observar que os efeitos do PEG 6000 são mais severos, pois ocorreu redução de 90% na germinação quando o potencial osmótico passou de 0,0 MPa para -0,3 MPa no experimento A e de 96% quando passou de 0,0 MPa para -0,45 MPa no experimento B.
O efeito mais severo provocado pelo PEG 6000 pode estar relacionado com a embebição das sementes, pois como as moléculas deste polímero apresentam dificuldade de atravessar a parede celular, reduzem drasticamente a absorção de água (Dodd & Donavan, 1999). Assim, a embebição ocorre de forma lenta, devido à pressão osmótica, retardando a ativação do metabolismo e, consequentemente, a germinação (Cavallaro et al., 2016).
Figura 1
Porcentagem de germinação de sementes de bracatinga (Mimosa scabrella Benth.)
em função de diferentes potencias osmóticos em soluções de NaCl e PEG 6000.
A = germinação experimento A; B = germinação experimento B.

No experimento A, a maior média referente a porcentagem de germinação foi observada para o tratamento controle (0,0 MPa) que apresentou 96,5% de germinação. Nos tratamentos com PEG 6000 a porcentagem de germinação foi reduzida drasticamente a partir do potencial de -0,3 MPa e -0,6 MPa (7,0% e 5,0%, respectivamente), sendo que a partir destes potenciais, a germinação tornou-se nula. Em contrapartida, para os tratamentos com NaCl a porcentagem de germinação foi reduzida de 91,0% (-0,3 MPa) para 29% em potencial osmótico de -0,6 MPa, apresentando valores próximos a zero no potencial de -1,2 MPa (4,5%). Resultados semelhantes também foram observados no experimento B, no qual a germinação para o tratamento controle foi em média 98,0%, apresentando reduções drásticas para aproximadamente 2,0% em potencial osmótico de -0,45 MPa para o PEG 6000, e de 39% para o NaCl.
Os dados do decréscimo acentuado na germinação das sementes de bracatinga, quando os níveis de potencial osmótico tornavam-se mais negativos, estão coincidentes com os resultados encontrados por MOURA et al. (2011) ao analisar o efeito dos estresses hídrico e salino em sementes de Mimosa caesalpiniifolia Benth, que também é uma espécie pertencente a família Fabaceae. Estes autores verificaram decréscimo de 90% na germinação para as sementes que foram submetidas ao PEG 6000 e de 50% para o NaCl, quando o potencial osmótico passou de 0,0 MPa para -0,5 MPa.
Os resultados verificados por PEREIRA et al. (2014), estudando o efeito do estresse hídrico em sementes de Raphanus raphanistrum e Senna obtusifolia, também corroboram o presente trabalho. Uma vez que, as condições de estresse prejudicaram a germinação e vigor das sementes destas espécies. Sendo que o estresse hídrico induzido pela solução de PEG 6000 foi mais crítico do que o induzido por NaCl, e o limite mínimo de germinabilidade foi verificado no potencial de -0,4 MPa. Em contrapartida, para Mimosa tenuiflora, as sementes mostraram menor tolerância ao estresse induzido por NaCl, pois houve uma redução de 95% para 9,5% do tratamento controle para -1,2 MPa, enquanto que para o PEG 6000 a porcentagem de germinação neste mesmo potencial osmótico foi de 53% (Bakke et al., 2006).
Existem diferentes valores de potencial hídrico externo abaixo do qual a germinação não ocorre, sendo determinado para cada espécie (Pereira et al., 2014). SPADETO et al. (2012) constataram que o estresse hídrico influenciou negativamente o desenvolvimento das plântulas e reduziu linearmente a porcentagem e a velocidade de germinação das sementes de Apuleia leiocarpa. Ainda, acrescentaram que em potencial osmótico de -1,2 MPa e -1,6 MPa as sementes mantiveram-se viáveis, porém não germinaram pela falta de condições hídricas que são necessárias para o início da germinação, ou seja, baixa disponibilidade de água.
A alta concentração de sais é um fator de estresse para as plantas, pois apresenta atividade osmótica, a qual retém a água, além da ação de íons sobre o protoplasma (Larcher, 2000; Yamashita & Guimarães, 2011). A água é retida osmoticamente em uma solução salina, de forma que o aumento da concentração de sais torna a água cada vez menos disponível para as plantas. Conforme GORDIN et al. (2012) a diminuição da disponibilidade hídrica ocasionada pela redução do potencial osmótico das soluções salinas reduziu gradativamente a porcentagem de germinação de Guizotia abyssinica, e o aumento da concentração das soluções influenciou negativamente o tempo para a germinação das sementes.
Com o intuito de analisar o efeito da salinidade, MASETTO et al. (2014) verificaram sensibilidade à salinidade para sementes de Dimorphandra mollis, pois os diferentes níveis de concentrações de CaCl2 e NaCl afetaram negativamente a qualidade fisiológica destas sementes, reduzindo significativamente a porcentagem de germinação e o índice de velocidade de germinação. Enquanto que, para Chorisia speciosa, o limite máximo de tolerância à salinidade ficou situado entre -1,0 e -1,2 MPa, sendo considerada uma espécie de moderada tolerância aos sais NaCl, KCl e CaCl2 (Fanti & Perez, 2004b).
Os efeitos menos drásticos provocados pelo NaCl podem estar atribuídos a uma possível tolerância da espécie a essa condição (Moura et al., 2011). Além disso, segundo FANTI & PEREZ (2004a) alguns agentes osmóticos de baixo peso molecular podem ser parcialmente absorvidos levando consigo a água, que é fundamental na germinação. Em contrapartida, os efeitos drásticos observados para o PEG 6000 podem ser atribuídos ao seu elevado peso molecular, ou a um declínio na absorção de água pelas sementes e não a um efeito tóxico, já que este composto é considerado inerte. Da mesma forma, pode estar atrelado à baixa difusão de O2 causado pela elevada viscosidade das soluções, que compromete a disponibilidade de oxigênio para o processo germinativo (Braccini et al., 1998).
O índice de velocidade de germinação (IVG), segundo SANTANA & RANAL (2004), é empregado para predizer o vigor relativo de amostras. Neste estudo foi utilizado o IVGm, proposto por esses autores como sendo uma modificação adequada para comparações, quando as amostras ou tratamentos apresentarem diferentes números de sementes germinadas. No segundo experimento, o IVGm apresentou decréscimo exponencial para os dois agentes osmóticos, apresentando resultados mais drásticos para o PEG 6000, conforme o potencial osmótico do meio tornava-se mais negativo (Figura 2). Pode-se observar que o IVGm foi reduzido gradativamente de 0,30 no tratamento controle para 0,11 em -0,45 MPa para o NaCl, enquanto que para o PEG 6000 a redução foi para 0,03 neste mesmo potencial osmótico.
Figura 2
Índice de velocidade de germinação médio (IVGm) de sementes de bracatinga
(Mimosa scabrella Benth.) em função de diferentes potencias osmóticos
em soluções de NaCl e PEG 6000.
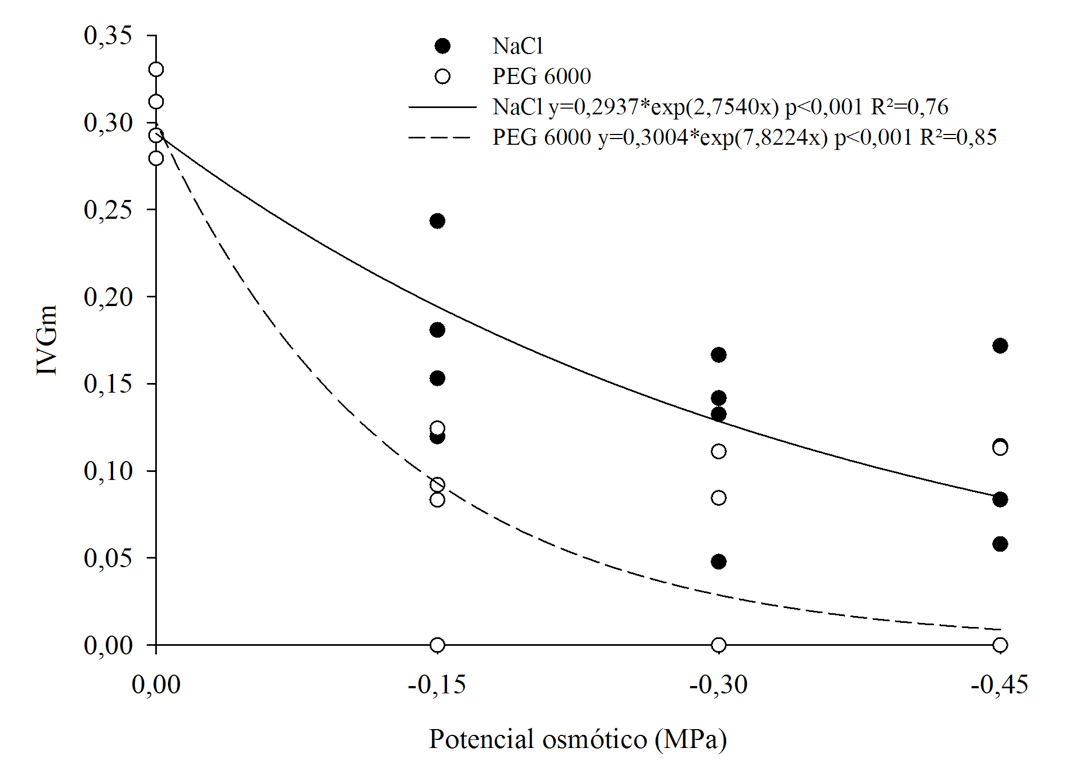
De acordo com PELEGRINI et al. (2013), o IVG das sementes de Erythrina falcata foi afetado osmoticamente por PEG 6000 em potenciais mais negativos que -0,4 MPa, o que também foi observado para as sementes de M. scabrella. Uma vez que, do tratamento controle para o potencial osmótico de -0,3 MPa, o IVGm foi reduzido de 0,159 para 0,088, alcançando valores próximos a zero, tanto para o IVGm quanto para a porcentagem de germinação em potenciais mais negativos que -0,6 MPa.
Para a espécie Anadenanthera colubrina, que também é uma espécie leguminosa, REGO et al. (2011) verificaram redução no IVG em PEG 6000 no potencial de -0,6 MPa. Na mesma linha de trabalho, GORDIN et al. (2012), estudando os efeitos do estresse salino em Guizotia abyssinica, encontraram redução gradativa no IVG conforme a diminuição do potencial osmótico das soluções de CaCl2, KCl e NaCl, evidenciando o efeito da salinidade no atraso da germinação das sementes.
O tempo médio de germinação (TMG) é uma variável importante para detectar a rapidez das sementes em germinar. O TMG foi estimado somente para o segundo experimento, o qual apresentou diferença significativa para os agentes osmóticos utilizados, onde as sementes submetidas às soluções de NaCl demoraram cerca de duas vezes mais para germinar (10,0 dias) em comparação ao PEG 6000 (5,2 dias) (Figura 3).
Figura 3
Tempo médio de germinação (TMG) de sementes de bracatinga (Mimosa scabrella Benth.)
em função das soluções de NaCl e PEG 6000.
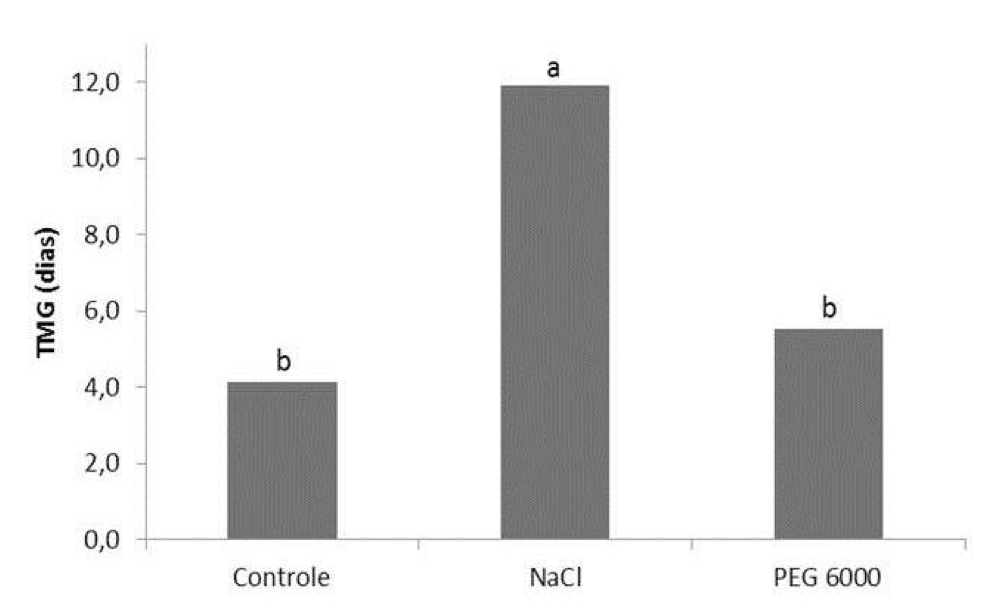
Os resultados de PELEGRINI et al. (2013) para a espécie Erythrina falcata apresentam similaridade com os verificados no presente trabalho, onde o TMG apresentou menor tempo médio para germinação no PEG 6000, não diferindo do tratamento controle, e foi progressivamente aumentado sob estresse osmótico. Neste caso, pode-se inferir que a germinação rápida é característica da espécie cuja estratégia é estabelecer-se no ambiente o mais rápido possível aproveitando as condições favoráveis ao desenvolvimento (Pelegrini et al., 2013).
Em contrapartida, REIS et al. (2012) constataram efeito contrário para o PEG 6000 em sementes de Erythrina velutina, onde obtiveram TMG de aproximadamente 12 dias no potencial de -0,6 MPa, valor bastante superior ao verificado no presente trabalho. Os resultados encontrados por MASETTO et al. (2014) também estão de acordo àqueles observados por REIS et al. (2012), pois verificaram tempo médio de germinação de aproximadamente 16 dias para sementes de Dimorphandra mollis em potencial osmótico de -0,7 MPa. No entanto, estes autores acrescentam que não houve diferenças significativas para este potencial osmótico e o tratamento controle.
Da mesma forma que para o tempo médio de germinação, o tempo médio para a formação de plântula (TMP) aumentou nos dois experimentos para as sementes submetidas ao NaCl (13,5 e 18,5 dias), enquanto que para o PEG 6000 o TMP foi de 5,1 no primeiro experimento (Figura 4A) e de 8,3 dias no segundo (Figura 4B).
Figura 4
Tempo médio para a formação de plântula (TMP) de bracatinga (Mimosa scabrella Benth.)
em função das soluções de NaCl e PEG 6000. A = TMP experimento A; B = TMP experimento B.

O atraso verificado no tempo médio de germinação e tempo médio para formação de plântulas de bracatinga submetidas aos tratamentos com NaCl, pode estar relacionado com a seca fisiológica induzida. Pois, com o aumento das concentrações de salinidade, ocorre uma redução no potencial osmótico, o que consequentemente irá reduzir também o potencial hídrico do meio. Esta diminuição no potencial hídrico afeta a absorção de água pela semente alterando o processo germinativo (Tobe et al., 2000).
No entanto, os resultados obtidos no presente estudo reforçam a hipótese de que a bracatinga é uma espécie promissora para o cultivo em solos salinos, pois sua germinação e formação de plântulas ocorreram de forma satisfatória nessas condições. De acordo com EMBRAPA (1999), um solo é considerado salino quando apresenta valores de condutividade elétrica maior ou igual a 4 e menor que 7 dS.m-1, e a partir de uma fórmula proposta por GHEYI et al. (2010), o potencial osmótico de um solo salino pode ser estimado com base na sua condutividade elétrica. Dessa forma, as condutividades de 4 a 7 dS.m-1 representariam valores de -0,14 a -0,25 MPa, o que comparando essa informação com os resultados obtidos no presente estudo, verifica-se que a bracatinga apresenta potencial para utilização em solos com essas condições. Contudo, são necessárias investigações sobre o crescimento dessas plantas em condições de estresse hídrico tais como testadas nesse trabalho a fim de comprovar essa hipótese.
As condições de elevada salinidade e déficit hídrico, em ambos os experimentos, prejudicaram a germinação e o índice de velocidade de germinação das sementes. No entanto, a bracatinga é uma espécie promissora para cultivo em solos com estresse hídrico, seja por baixa precipitação, seja por solo salino, pois a germinação e a formação de plântulas ocorreram de forma satisfatória em potenciais osmóticos que estes solos apresentam.
Os efeitos do estresse causado pelo NaCl foram menos drásticos, pois a germinação tornou-se nula apenas em potencial osmótico de -1,2 MPa, enquanto que para o PEG 6000 isso ocorreu a partir de -0,6 MPa.
Bakke, I. A., Freire, A. L. O., Bakke, O. A., Andrade, A. P., & Bruno, R. L. A. (2006). Water and sodium chloride effects on Mimosa tenuiflora (Willd.) poiret seed germination. Revista Caatinga, 19(3), 261-267.
Betoni, R., Scalon, S. P. Q., & Mussury, R. M. (2011). Salinidade e temperatura na germinação e vigor de sementes de mutambo (Guazuma ulmifolia Lam.) (Sterculiaceae). Árvore, 35(3), 605-616.
Braccini, A. L., Reis, M. S., Sediyama, C. S., Sediyama, T., & Rocha, V. S. (1998). Influência do potencial hídrico induzido por polietilenoglicol na qualidade fisiológica de sementes de soja. Pesquisa Agropecuária Brasileira, 33(9), 1451-1459.
Cavallaro, V., Barbera, A. C., Maucieri, C., Gimma, G., Scalisi, C., & Patane, C. (2016). Evaluation of variability to drought and saline stress through the germination of different ecotypes of carob (Ceratonia siliqua L.) using a hydrotime model. Ecological Engineering, 95, 557-566.
Dodd, G. L., & Donovan, L. A. (1999). Water potential and ionic effects on germination and seedling growth of two cold desert shrubs. American Journal of Botany, 86(8), 1146-1153.
Embrapa. (1999). Sistema brasileiro de classificação de solos. Rio de Janeiro: Embrapa Solos.
Fabrowski, F. J., Muñiz, G. I. B., Mazza, M. C. M., Nakashima, T., Klock, U., Possamai, J. C., & Nisgoski, S. (2005). Anatomia comparativa da madeira das variedades populares da bracatinga (Mimosa scabrella Bentham). Ciência Florestal, 15(1), 65-73.
Fanti, S. C., & Perez, S. C. J. G. A. (2004a). Efeito do estresse hídrico e envelhecimento precoce na viabilidade de sementes osmocondicionadas de paineira (Chorisia speciosa). Pesquisa Agropecuária Brasileira, 38(4), 537-543.
Fanti, S. C., & Perez, S. C. J. G. A. (2004b). Processo germinativo de sementes de paineira sob estresses hídrico e salino. Pesquisa Agropecuária Brasileira, 39(9), 903-909.
Gheyi, H. R., Dias, N. S., & Lacerda, C. F. (2010) Manejo da salinidade na agricultura: estudos básicos e aplicados. Fortaleza: INCT Sal.
Gordin, C. R. B., Marques, R. F., Masetto, T. E., & Souza, L. C. F. (2012). Estresse salino na germinação de sementes e desenvolvimento de plântulas de niger (Guizotia abyssinica (L.f.) Cass.). Acta Botanica Brasilica, 26(4), 966-972.
Larcher, W. (2000). Ecofisiologia vegetal. São Carlos: Rima.
Machado, S. A., Urbano, E., Jarschel, B., Teo, S. J., Figura, M. A., & Silva, L. C. R. (2006). Relações quantitativas entre variáveis dendrométricas e teores de carbono para Mimosa scabrella Bentham da região metropolitana de Curitiba. Boletim de Pesquisa Florestal, 52, 37-60.
Maguire, J. D. (1962). Speed of germination – aid in selection and evaluation for seedling emergence and vigor. Crop Science, 2(2), 176-177.
Masetto, T. E., Scalon, S. P. Q., Rezende, R. K. S., Oba, G. C., Gambatti, M., & Patrício, V. S. (2014). Germinação de sementes de Dimorphandra mollis Benth.: efeito de salinidade e condicionamento osmótico. Revista Brasileira de Biociências, 12(3), 127-131.
Michel, B. E., & Kaufmann, M. R. (1973). The osmotic potential of polyethylene glycol 6000. Plant Physiology, 51, 914-916.
Moura, M. R., Lima, R. P., Farias, S. G. G., Alves, A. R., & Silva, R. B. (2011). Efeito do estresse hídrico e do cloreto de sódio na germinação de Mimosa caesalpiniifolia Benth. Verde, 6(2), 230-235.
Navroski, M. C., & Pereira, M. O. (2014). Melhoramento genético. En Mazuchowski, J. Z., Rech, T. D., & Toresan, L. (Org.), Bracatinga, Mimosa scabrella Bentham: cultivo, manejo e usos da espécie (pp. 76-95). Florianópolis: Epagri.
Pelegrini, L. L., Borcioni, E., Nogueira, A. C., Koehler, H. S., & Quoirin, M. G. G. (2013). Efeito do estresse hídrico simulado com NaCl, Manitol e PEG (6000) na germinação de sementes de Erythrina falcata Benth. Ciência Florestal, 23(2), 511-519.
Pereira, M. R. R., Martins, C. C., Martins, D., & Silva, R. J. N. (2014). Estresse hídrico induzido por soluções de PEG e de NaCl na germinação de sementes de nabiça e fedegoso. Bioscience Journal, 30(3), 687-696.
Pereira, M. R. R., Martins, C. C., Souza, G. S. F., & Martins, D. (2012). Influência do estresse hídrico e salino na germinação de Urochloa decumbens e Urochloa ruziziensis. Bioscience Journal, 28(4), 537-545.
Rego, S. S., Ferreira, M. M., Nogueira, A. C., Grossi, F., Sousa, R. K., Brondani, G. E., Araujo, M. A., & Silva, A. L. L. (2011). Estresse hídrico e salino na germinação de sementes de Anadenanthera colubrina (Veloso) Brenan. Journal of Biotechnology and Biodiversity, 2(4), 37-42.
Reis, R. C. R., Dantas, B. F., & Pelacani, C. R. (2012). Mobilization of reserves and germination of seeds of Erythrina velutina Willd. (Leguminosae – Papilionoideae) under different osmotic potentials. Revista Brasileira de Sementes, 34(4), 580-588.
Rosa, F. C., Reiniger, L. R. S., Golle, D. P., Muniz, M. F. B., & Curti, A. R. (2012). Superação de dormência e germinação in vitro de sementes de bracatinga (Mimosa scabrella Bentham). Ciências Agrárias, 33(3), 1021-1026.
Santana, D. G., & Ranal, M. A. (2004). Análise da germinação: um enfoque estatístico. Brasília: Editora da Universidade de Brasília.
Silva, M. B. R., Viégas, R. A., Dantas Neto, J., & Farias, S. A. R. (2009) Estresse salino em plantas da espécie florestal sabiá. Caminhos de Geografia, 10, 120-127.
Spadeto, C., Lopes, J. C., Mengarda, L. H. G., Matheus, M. T., & Bernardes, P. M. (2012). Estresse salino e hídrico na germinação de sementes de garapa (Apuleia leiocarpa (VOGEL.) J.F. Macbr. Enciclopédia Biosfera, 8(14), 539-551.
Tobe, K., LI, X., & Omasa, K. (2000). Seed germination and radicle growth of a halophyte, Kalidium caspicum (Chenopodiaceae). Annals of Botany, 85, 391-396.
Yamashita, O. M., & Guimarães, S. C. (2011(. Efecto del estrés salino sobre la germinación de las semillas de Conyza canadensis y Conyza bonariensis. Bioagro, 23(3), 169-174.
1. Engenheira Florestal. Mestre em Fitotecnia. Departamento de Horticultura e Silvicultura. Universidade Federal do Rio Grande do Sul. dudademari@hotmail.com
2. Bióloga. Mestre em Fitotecnia. bbaratto@hotmail.com
3. Engenheiro Florestal. Mestre em Fitotecnia. juliorieger@gmail.com
4. Engenheiro Florestal. Doutor. Professor do Centro de Ciências Agroveterinárias. Universidade do Estado de Santa Catarina. navroski@cav.udesc.br
5. Engenheiro Agrônomo. Doutor. Professor do Departamento de Horticultura e Silvicultura. Universidade Federal do Rio Grande do Sul. csfior@ufrgs.br