

Vol. 39 (Nº 37) Ano 2018 • Página 17
Seidel Ferreira dos SANTOS 1; Alberdan Silva SANTOS 2; Rosana Silva CORPES 3; Noemi Vianna Martins LEÃO 4
Recebido: 27/03/2018 • Aprovado: 11/05/2018
RESUMO: Libidibia ferrea, espécie conhecida popularmente na Amazônia como jucá, possui aplicação na medicina popular, evidenciando atividades antifúngicas, antibacterianas, antiulcerogênicas, antiinflamatórias e cicatrizantes. Flavonóides, ácidos fenólicos e esteroides podem estar relacionadas às ações terapêuticas, justificando a aplicação de técnicas da biotecnologia para verificar da produção de calos embriogênicos com vistas à produção de metabólitos e o desenvolvimento de sistemas de cultura de células. |
ABSTRACT: Libidibia ferrea, a species popularly known in the Amazon as jucá, has application in folk medicine, evidencing antifungal, antibacterial, antiulcerogenic, anti-inflammatory and cicatrizant activities. Flavonoids, phenolic acids and steroids may be related to therapeutic actions, justifying the application of biotechnology techniques to verify the production of embryogenic calluses in order to produce metabolites and the development of cell culture systems. |
O uso de plantas pela humanidade é uma prática antiga e pode ser observado em diferentes culturas e níveis de desenvolvimento. A busca pelo alívio e cura de doenças, por meio da ingestão de ervas, raízes e folhas, talvez tenha sido uma das primeiras formas de utilização desses recursos. No entanto, a busca contínua por produtos oriundos das florestas e as transformações nos ecosistemas em função da antropização tem levado um grande número de espécies de plantas ao processo de erosão genética.
França (2017); Zanin et al, (2012) destacam que as substâncias de origem vegetal servem como a principal fonte de compostos orgânicos para aplicação na medicina, cosméticos, indústria de alimentos e setores da biotecnologia. O aumento no número de pesquisas com metabólitos secundários têm permitido o uso com segurança destes compostos em diferentes processos biotecnológicos, no entanto, a sazonalidade e baixa produtividade in vivo são fatores limitantes a produção. Diante da importância deste setor no mercado e o esgotamento acelerado destes recursos surge a necessidade da criação de novas estratégias voltadas ao cultivo, produção de moléculas biologicamente ativas e conservação dos recursos genéticos vegetais. Neste sentido o cultivo in vitro de células e tecidos vegetais tem se destacado como uma alternativa promissora na produção de metabólitos de interesse biológico. Para otimização destes processos as técnicas de cultura devem ser associadas às ferramentas analíticas sofisticadas como RMN, HPLC, GC-MS e LC-MS (Kumar, 2004). O principal objetivo do estabelecimento de bioprocessos in vitro está associado ao fato de que as atividades enzimáticas catalíticas e rotas metabólicas podem ser monitoradas. As técnicas de cultura in vitro de células e tecidos possibilitam a geração de plântulas axênicas e suspensões celulares em quantidades apreciáveis para os estudos de biossíntese e genômica uma vez que essas culturas sejam competentes, isto é, produzam os metabólitos-alvo como as espécies nativas das quais foram derivadas. (França, 2017).
L. ferrea é uma espécie arbórea bastante conhecida na medicina popular, sendo suas diferentes partes utilizadas no tratamento de várias doenças e sintomas. Diante de sua importância etnofarmacológica, o Ministério da Saúde brasileiro incluiu esta espécie na Lista Nacional de Plantas Medicinais importantes para o Sistema de Saúde. Na literatura Libidibia ferrea (jucá) apresenta muitos registros sobre suas atividades antifúngicas, antibacterianas, antiulcerogênicas, analgésicas e antiinflamatórias (Carvalho et al.,1996).
O presente trabalho evidencia as possibilidades de aplicação de técnicas da biotecnologia vegetal na iniciação da cultura e o estabelecimento in vitro desta espécie florestal bem como o desenvolvimento de tecnologia avançada para multiplicação de biomassa como estratégia para produção e o acúmulo de metabólitos de interesse.
Espécie conhecida na região amazônica como Jucá, em outras regiões do Brasil pode ser denominada como Pau-ferro ou Pau-ferro verdadeiro. Ocorre no Piauí, Alagoas, Bahia, Espírito Santo e Rio de Janeiro com ampla dispersão, porém geralmente em baixa densidade populacional (Queiroz, 2009; Lorenzi, 2008). Produz anualmente moderada quantidade de sementes viáveis, floresce a partir do final de novembro, prolongando-se até janeiro. Os frutos amadurecem no período de julho a agosto (Figura 01).Para obtenção de sementes, os frutos devem ser colhidos diretamente da árvore quando adquirirem coloração escura e iniciarem a queda espontânea, ou deve-se recolhê-los no chão após a queda, 1 (um) quilograma contém aproximadamente 5.200 unidades, cuja viabilidade dura mais de 8 meses (Lorenzi, 2008).
Figura 1
Libidibia ferrea (Mart. Ex Tul.) L.P. QUEIROZ A- Aspecto geral da floração;
B- Detalhe do caule; C- Fruto maduro; D- Aspecto geral da semente;
E-Distribuição e ocorrência.

Libidibia ferrea faz parte do antigo grupo Caesalpinia onde seus componentes apresentam alta diversidade química, contribuindo com novas estruturas químicas e aplicações terapêuticas. Entre os metabólitos descritos para as espécies de Caesalpinia predominam os derivados fenólicos, esteróides e triterpenóides. Com relação ao jucá (L. ferrea), estudos fitoquímicos apontam a presença de flavonóides, saponinas, taninos, cumarinas, esteróides e compostos fenólicos como possíveis classes de metabólitos responsáveis por suas atividades biológicas (Gonzalez, 2005).
O termo cultura de tecidos vegetais tem sido bastante utilizado para definir a cultura asséptica in vitro de células, tecidos, órgãos e seus componentes sob condições físicas e químicas definidas. A cultura de tecidos constitui uma importante ferramenta para estudos básicos, como a compreensão dos fatores responsáveis pelo crescimento, metabolismo, diferenciação e morfogênese das células vegetais, bem como para estudos aplicados, como micropropagação, manutenção de germoplasma in vitro, limpeza clonal e produção de metabólitos (Silva-Neto, Andrade, 2011).
Segundo Viana et al. (1999), os estudos básicos sobre cultura in vitro e biotecnologia da conservação, são as bases para o estabelecimento de estratégias de conservação de espécies nativas brasileiras, a curto, médio e longo prazo. As técnicas de cultura in vitro possibilitam a obtenção de plantas inteiras a partir de células isoladas, de tecidos e de órgãos. Constituindo assim, uma alternativa para conservação de espécies propagadas vegetativamente ou com sementes de baixo potencial de armazenamento (Pence, 1999).
O princípio básico da cultura de tecidos é a totipotencialidade das células, ou seja, qualquer célula vegetal pode gerar uma nova planta com o uso de indutores apropriados e na escolha de variedades químicas de elevado rendimento, tem proporcionando obter um peso de massa celular seca, de cinco a dez vezes superiores à que é obtida a partir da própria planta (Torres et al., 1998).
A maioria das plantas medicinais que possuem protocolos de cultura de tecidos bem estabelecidos são herbáceas em função da dificuldade encontrada no processo de propagação das plantas lenhosas para cultivo in vitro por uma maior produtividade de metabólitos secundários. O fator principal para o sucesso da produção em escala comercial de substâncias biologicamente ativas é a capacidade de crescer células em larga escala, onde a organogênese indireta, passando pela fase de calo, tem sido a forma mais preconizada para a obtenção de elevadas taxas de multiplicação in vitro (Paranhos, 2014).
Calos são tecidos não diferenciados predominantemente constituídos por células parenquimatosas, que apresentam grandes vacúolos e formas variadas. Quanto ao formato das células algumas podem se apresentar compactadas e justapostas (calos nodais), outras se apresentam friáveis com largos espaços intercelulares (Paranhos, 2014).
As metodologias para obtenção de calos de várias espécies vegetais são amplamente conhecidas (Dixon, 1985; Evans et al. 1981;), mas adaptações nos métodos de desinfestação superficial, na obtenção de explantes e na suplementação do meio de cultivo, são ainda necessárias, especialmente para novas cultivares, espécies vegetais menos estudadas e estudos com objetivos específicos.
Silva-Neto, Andrade (2011) destaca que para a obter sucesso no estabelceimento de protocolos na micropropagação in vitro é importante que se conheça alguns aspectos relacionados a planta matriz, como estádio de desenvolvimento, qualidade do genótipo, as condições de estresse a que a planta está submetida, luminosidade, presença de compostos fenólicos ente outros.
Os ensaios de cultivo in vitro foram realizados no Laboratório de Biotecnologia Vegetal que integra o Laboratório de Investigação Sistemática em Biotecnologia e Biodiversidade Molecular (Labisisbio/ICEN/UFPA). Para realização dos experimentos foram utilizadas sementes maduras de Jucá (Libidibia ferrea), estas foram previamente selecionadas, sendo descartadas as que apresentavam deformidades causadas possivelmente por broca. A assepsia inicial das mesmas se constituiu de duas lavagens com água destilada com adição de Tween 80, em seguida as mesmas foram imersas em etanol a 70% (v/v) por (5 min), NaClO a 10% (20 min), sendo submetidas a uma lavagem com água destilada e imersas em fungicida Derosal 5% (v/v) por (60 min). A remoção do excesso de fungicida foi feita através de duas lavagens com água estéril e em seguida houve a imersão das sementes em solução de Nitrato de Oxiconazol + Cloranfenicol 25 mg.L-1 tendo estas permanecido em agitador orbitalar por um período de 24 horas. Em câmara de fluxo laminar, as sementes que já haviam sido submetidas à pré-assepsia foram novamente submetidas a uma lavagem com água destilada estéril, imersas em etanol a 70% (v/v) por (5 min), NaClO a 10% por (5min) e 5 lavagens com água destilada estéril, posteriormente as mesmas foram imersas em solução de Rifampicina a 0,1% (v/v) por 30 min. Em seguida as sementes e/ou embriões foram inoculadas em meio de cultura MS suplementado com sacarose 3% (m/v), solidificado com Phytagel 0,2% (m/v).
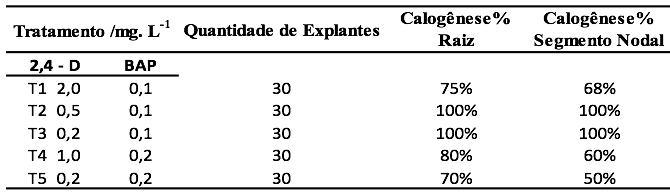
Para indução de calos de Libidibia ferrea, foram realizados ensaios em meio MS acrescido dos reguladores de crescimento BAP (6-Benzilaminopurina) e 2,4-D (ácido 2,4- Diclorofenoxiacético) obedecendo a uma matriz de planejamento (Tabela 01), onde se destacaram os tratamentos 0,5 mg.L-1de 2,4-D e 0,1 mg.L-1de BAP e 0,2 mg.L-1de 2,4-D e 0,1 mg.L-1de BAP como sendo os melhores para tal finalidade. Como fonte de explantes foram utilizados segmentos nodais e raízes sendo possível obter a indução destes calos mesmo quando a semente inicia o processo de emissão da radícula.
Tabela 1
Efeito da concentração de 2,4D e BAP, tipo de explantes sobre a indução e
morfogênese de calos de Libidibia ferrea cultivados durante 40 dias em meio de
cultura Murashige & Skoog, semi-sólido.
As observações mostraram que sementes maduras de Libidibia ferrea após serem submetidas ao processo de desinfestação foram capazes de gerar plântulas axênicas cultivadas em meio MS. As plântulas cultivadas in vitro mostraram-se eficazes como doadoras de explantes para iniciação a cultura. As estruturas selecionadas para indução a calogênese foram segmentos nodais e raízes primárias no início de desenvolvimento (Figura 02). Esta etapa é considerada uma das mais importantes no processo de cultivo in vitro de espécies arbóreas. Paranhos (2014) destacaram que o primeiro passo ao estabelecimento de linhagens celulares e quimiotipos altamente produtivos reside na escolha do tipo de material vegetal a ser utilizado como explante para iniciação das culturas in vitro. Estes autores alertam para a observação do estado fisiológico da planta original e idade, pois tecidos mais jovens apresentam, maior possibilidade de se obter uma cultura viável. Em L. ferrea foi possível observar que explantes retirados de plântulas cultivadas até o 15º dia apresentaram melhores respostas quanto à indução de calos. Torres et al (1998) ao tratar de limitações para o estabelecimento in vitro de espécies lenhosas destaca que este processo depende de explantes novos e preferencialmente juvenis; os explantes devem ser originados de matrizes em crescimento ativo (sem estresse) e com mínimo de dano mecânico e químico na fase de desinfestação, além de possuir meio de cultura e ambiente de cultivos apropriados e cuidados com a oxidação fenólica.
Figura 2
Libidibia ferrea. A-Plântula originada da cultura de embriões zigóticos;
B-Plântula originada de sementes maduras;
C-Segmento nodal de plântula utilizada como explante para indução de calos;
D-Segmento de raiz utilizada como explante para indução de calos.

Ápices caulinares ou segmentos nodais contendo gemas axilares são mais utilizados quando o objetivo é a obtenção de plântulas a partir de meristemas pré-existentes. A cultura de ápices caulinares é o sistema indicado para a propagação clonal in vitro e a conservação de germoplasma (Mansur et al, 2009), neste estudo foi observado que os meristemas presentes em segmentos nodais e ápices de raízes das plântulas mostraram-se favoráveis para indução de calos (Figura 03).
Figura 3
Libidibia ferrea (Mart. Ex Tul.) L.P. QUEIROZ. Calos em meio de cultura MS após
a adição dos reguladores de crescimento 2,4-D e BAP. A- Calos originados de raiz; B- Calos originados de segmento nodal;
C- Detalhe de calos compactados; C- Calos obtidos de segmento nodal com células compactadas e justapostas (Nodal);
D- Calos originados de segmentos de raízes cultivadas in vitro com predominância de células friáveis.

A manutenção do crescimento contínuo dos calos in vitro é assegurada através da transferência periódica, sob condições assépticas, de pequenas porções de tecido para novos meios de cultura (Paranhos, 2014). Este procedimento, vulgarmente denominado repicagem, é necessário porque a contínua proliferação do calo torna o meio de cultura progressivamente mais desidratado e mais pobre em nutrientes, ao mesmo tempo em que se verifica uma acumulação de produtos do metabolismo celular que podem atingir níveis tóxicos.
O desenvolvimento de um calo a partir do cultivo de um explante compreende algumas etapas distintas como: indução, divisão e diferenciação. Neste estudo, foi possível induzir a calogênese com uso dos reguladores de crescimento classificados como auxinas e citocininas, que neste caso foram o 2,4-D (2,4- Diclorofenoxiacético) e BAP (6-Benzilaminopurina) em diferentes concentrações (Tabela 01). Diante dos resultados apresentados foi possível estabelecer uma série de subcultivos seletivos das populações mais adaptadas às condições de cultivo para determinação de uma linhagem de células com taxas de crescimento satisfatórias para aumento de biomassa.
Após estabelecido o sistema de cultivo, se obteve uma linhagem de células competentes calulósicas que serão usadas para aumento de biomassa e sistema de produção de metabólitos in vitro em escala preparativa ou piloto. Dessa maneira a busca por novas alternativas de produção de metabólitos é apresentada neste trabalho direcionando as metodologias necessárias para o desenvolvimento de um processo estabelecido, principalmente para espécies lenhosas como é o caso de Libidibia ferrea.
Carvalho, J. C. T.; Teixeira, J. R. M.; Souza, P. J. C.; Bastos, J. K.; Santos Filho, D.; Sarti, S. J. (1996). Preliminary studies of analgesic and anti-inflammatory properties of Caesalpinia ferrea crude extract. Journal of Ethnopharmacology, 53, (175-178).
Dixon, R.A. (1985) Isolation and maintenance of callus and ceil suspension cuitures. In: Plant cell culture (1-20) Oxford, IRL Press.
Evans, D.A.; Sharp, W.R.; Fuck, C.E (1981) Growth and behavior of cell cultures embryogenesis and organogenesis. In: Thorpe, T.A. ed. Plant tissue culture, methods and applications in agricultura (45-114) New York, Academic Press.
França, S. C. (2017). Bioprocessos inovadores para produção de metabólitos ativos de plantas. In: C. M. O. Simões, E. P. Schenkel, J. C. P. Mello, L. A. Mentz, P. R. Petrovick. Farmacognosia do produto natural ao medicamento. (39-52). Porto Alegre. Artmed
Gonzalez, F. G.(2005). Estudo farmacognóstico e farmacológico de Caesalpinia ferrea Martius. (Tese) Faculdade de ciências farmacêuticas, Universidade de São Paulo, São Paulo, SP.
Kumar, B; Prakash, A; Ruhela, R; Medhi, B. (2014). Potential of metabolomics in preclinical and clinical drug development. Pharmacological Reports 66: (956-963).
Lorenzi, H. (2008). Árvores Brasileiras: Manual de Identificação e Cultivo de plantas arbóreas nativas do Brasil. Nova Odessa. Editora Plantarum.
Mansur, E.; Pacheco, G. P; Carneiro, M. L. V. (2009). Conservação in vitro de germoplasma. In: A. Borém. (Org.). Domesticação e Melhoramento de Plantas.(171-191) Viçosa: UFV.
Murashige. T; Skoog F. (1962). A revised medium for rapid growth and bioassays with tobaco tissue cultures. Physiology Plantarum. V(15), 473-479.
Paranhos, A (2014) Cultura de células e tecidos vegetais in vitro : uma fornte alternativa de metabólitos secundários. In Cunha, A. P. da. Farmacognosia e Fitoquímica (61-88). Lisboa: Calouste Gulbenkian.
Pence, V. C. (1999) The Application of Biotechnology for the Conservation of Endangered
Plants. In: Plant Conservation Biotechnology. Cap 6(p83-95) London: Taylor & Francis.
Queiroz, L.P. (2009). Leguminosas da Caatinga. Universidade Estadual de Feira de Santana, Feira de Santana.
Silva-Neto, S.P; Andrade, S. R. M (2011) Cultura de tecidos vegetais: princípios e aplicações. In: Faleiro, F.G.; Andrade, S.R.M. de. (Org.). Biotecnologia: estado da arte e aplicações na agropecuária (410-434) Planaltina DF: Embrapa Cerrados.
Torres, A. C.; Caldas, L. S.; Buso, J. A. (1998) Cultura de Tecidos e Transformação Genética de Plantas. 1ª ed. Brasília: Embrapa-SPI
Viana, A. M.; Mazza, M. C.; Mantell, S. (1999) Applications of biotechnology for the conservation and sustainable exploitation of plants from Brazilian Rain forests. In: Benson, E. E. Plant Conservation Biotechnology. Cap.18 (277-299) London: Taylor & Francis.
Zanin, J. L. B; Carvalho, B.A; Martineli, P. S; Santos; M.H; Lago, J. H. G & Sartorelli, P.(2012), The genus Caesalpinia L. (Caesalpiniaceae): phytochemical and pharmacological characteristics. Molecules 17 (7887-7902).
1. Doutorando do Programa de Biodiversidad e Biotecnologia (PPGBionorte/Pará). botanish@yahoo.com.br
Professor. Labisisbio (UFPa). alberdan.ufpa@gmail.com
2. Professor. Labisisbio (UFPa). alberdan.ufpa@gmail.com
3. Doutoranda do Programa de Pós-graduação em Biotecnologia (PPGBiotec-UFPa) rosanacorpes@hotmail.com
4. Pesquisadora. Embrapa Amazônia Oriental. noemi.leao@embrapa.br